欧盟批准瑞戈非尼用于治疗胃肠间质瘤
记者从拜耳医药获悉,该公司生产的抗肿瘤药物Stivarga(瑞戈非尼)已被欧盟委员会(EC)批准用于治疗患有不可切除或转移性胃肠间质瘤(GIST)且在既往伊马替尼及苏尼替尼治疗后疾病进展或无法耐受的成年患者。Stivarga被批准用于治疗胃肠间质瘤依据的是关键性III期研究(GRID)的结果,这项研究在既往治疗后疾病进展的胃肠间质瘤患者中证明了在无进展生存期(PFS)方面与安慰剂相比的统计上显著的改善。
“继Stivarga在包括美国和日本在内的全球多个国家获批用于治疗胃肠道间质瘤之后,我们很高兴能为欧洲的患者提供治疗这一罕见而恶性癌症的新选择,”拜耳医药保健执行委员会成员及全球研发总监JoergMoeller博士如是说,“在拜耳,我们致力于为不同的肿瘤类型探索解决方案,并推动创新以满足医师及患者未满足的需求。”
“胃肠间质瘤是一种具有高度侵袭性的癌症,其可能持续多年不被发现,且在诊断之时,大多数患者已进展至疾病的晚期。在伊马替尼及舒尼替尼治疗后,生存率较低且治疗方法有限,”GRID研究者、克洛德贝纳尔-里昂第一大学(法国里昂)里昂贝纳尔中心内科肿瘤学医学教授及内科肿瘤系主任JeanYves-Blay如是说,“III期GRID试验证明了使用瑞戈非尼的无进展生存期是使用安慰剂的五倍以上。”
瑞戈非尼已在包括美国及日本在内的多个国家以Stivarga的商标名获得批准,用于治疗胃肠道间质瘤。该产品同时在包括美国、欧洲及日本在内的全球60个国家被批准用于治疗转移性结直肠癌(mCRC)患者。
关于GRID研究
GRID(GIST——瑞戈非尼用于进展性疾病[GIST–RegorafenibInProgressiveDisease])为一项瑞戈非尼用于治疗胃肠间质瘤的随机化、双盲、安慰剂对照、多中心III期研究。该研究将199名在接受过既往伊马替尼及舒尼替尼治疗后疾病进展的患者被以2:1的比率随机接受瑞戈非尼加最佳支持治疗或安慰剂加最佳支持治疗,以评价有效性及安全性。治疗周期包括160mg瑞戈非尼(或匹配安慰剂)每日一次,持续三周给药/一周停药,加上最佳支持治疗。主要终点为无进展生存期,次要终点包括总生存期(OS)、至疾病进展的时间、疾病控制率、肿瘤缓解率以及缓解持续时间。同时对比了两个治疗组的安全性及耐受性。允许最初被随机化至安慰剂组的患者在发生疾病进展时立即交叉至开放标签瑞戈非尼。
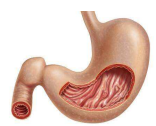
关于胃肠间质瘤(GIST)
胃肠间质瘤是一种发生于胃肠道肌层的最常见的肉瘤形式。胃肠间质瘤如果扩散到身体其他部位(转移),或无法通过治愈性外科手术被移除,则将构成威胁生命的恶性肿瘤。在全球,预估每年每一百万人中有11至20人受胃肠道间质瘤的影响。
相关新闻推荐:瑞戈非尼显著延长转移性结直肠癌亚洲患者生存期